Альдегидтер - құрамында -CH функционалдық тобы бар карбонил қосылыстарына жататын органикалық заттар, ол карбонил тобы деп аталады.
Молекуланың көмірсутек қаңқасының табиғатына байланысты альдегидтер қаныққан, қанықпаған және хош иісті болады. Олардың молекулаларында галоген атомдары немесе қосымша функционалдық топтар болуы мүмкін. Қаныққан альдегидтердің жалпы формуласы C H2 O. IUPAC номенклатурасына сәйкес олардың атаулары -al.
жұрнағымен аяқталады.
Альдегидтердің тотығуының өнеркәсіпте маңызы зор, өйткені олар карбон қышқылдарына оңай айналады. Бұл жағдайда мыс гидроксиді, күміс оксиді немесе тіпті атмосфералық оттегі тотықтырғыш ретінде қызмет ете алады.
Карбонил тобының құрылымы
С=О тобындағы қос байланыстың электрондық құрылымы бір σ-байланыстың және тағы бір π-байланыстың түзілуімен сипатталады. С атомы sp2-гибридтену күйінде, байланыстар арасындағы байланыс бұрыштары шамамен 1200 болатын жазық молекула. Бұл функционалды топтағы қос байланыстың айырмашылығы оның көміртегі атомы мен электртерістігі жоғары оттегі атомы арасында орналасуында. Нәтижесіндеэлектрондар O атомына тартылады, яғни бұл байланыс өте күшті поляризацияланған.
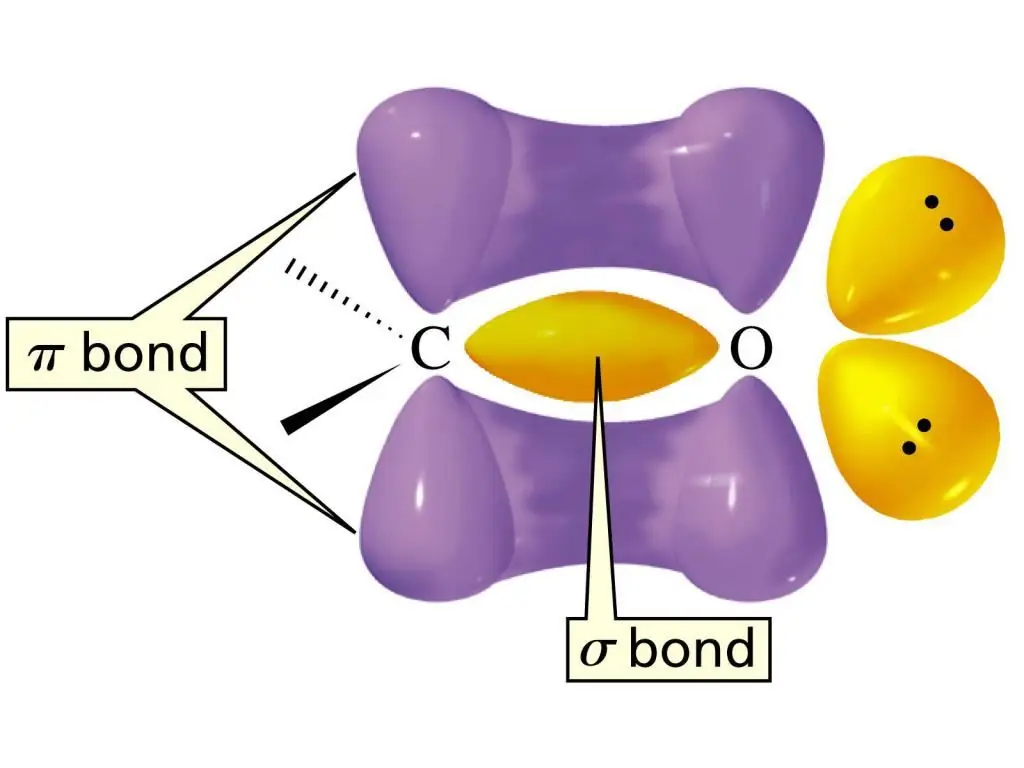
Альдегидтер тобындағы мұндай поляризацияланған қос байланыстың мазмұнын альдегидтердің жоғары реакцияға түсуінің негізгі себебі деп атауға болады. Альдегидтер үшін С=О байланысына атомдардың немесе олардың топтарының қосылу реакциялары барынша тән. Ал нуклеофильді қосылу реакциялары ең оңай орындалады. Альдегидтерге альдегидтердің функционалдық тобынан Н атомдары қатысатын реакциялар да тән. С=О тобының электрондарды тартып алу әсерінен байланыстың полярлығы артады. Бұл өз кезегінде альдегидтердің салыстырмалы түрде оңай тотығуының себебі болып табылады.
Альдегидтердің кейбір өкілдері
Формальдегид (формальдегид немесе метанал) CH2O - әдетте метанол буының ауамен қоспасын қызыл түстен өткізу арқылы алынатын өте өткір иісі бар газ тәрізді зат. -мыс немесе күміс тордың ыстық торы. Оның 40% сулы ерітіндісі формалин деп аталады. Формальдегид реакцияларға оңай енеді, олардың көпшілігі бірқатар маңызды заттардың өнеркәсіптік синтезінің негізінде жатыр. Сонымен қатар изопрен каучукін, пентаэритритолды, көптеген дәрілік заттарды, әртүрлі бояғыштарды алуға, теріні илеуге, дезинфекциялаушы және дезодорант ретінде пайдаланады. Формальдегид айтарлықтай улы, оның ауадағы ШРК 0,001 мг/л.
Ацетальдегид (сірке альдегиді, этанал) CH3SON - тұншықтырғыш иісі бар түссіз сұйықтық, сумен сұйылтқандажеміс хош иісі. Ацетальдегид альдегидтердің барлық негізгі қасиеттеріне ие. Сірке альдегидінің тотығуы үлкен мөлшерде сірке қышқылы мен сірке ангидридін, әртүрлі фармацевтикалық препараттарды шығарады.
Акролеин (пропенал) CH2=CH-SON, ең қарапайым қанықпаған альдегид - түссіз, ұшқыш сұйықтық. Оның булары көздің және жоғарғы тыныс жолдарының шырышты қабығын қатты тітіркендіреді. Өте улы, оның ауадағы ШДК мөлшері 0,7 мг/м3. Пропенал белгілі бір полимерлердің синтезіндегі аралық өнім болып табылады және белгілі бір препараттарды өндіруде қажет.

Бензальдегид (бензой альдегиді) С6Н5SON - ащы бадам иісі бар, сақтау кезінде сарыға айналатын түссіз сұйықтық. Ол ауамен тез бензой қышқылына дейін тотығады. Өсімдіктердің эфир майларында (нероли, пачули), ал глюкозид түрінде - ащы бадам, шие, өрік және шабдалы тұқымдарының ядросында болады. Хош иісті зат ретінде парфюмерияда, тағамдық эссенциялардың құрамдас бөлігі ретінде, басқа хош иісті заттарды (циннамальдегид, жасминальдегид) синтездеу үшін шикізат ретінде қолданылады.
Күміс айна реакциясы
Альдегидтердің күміс оксидімен тотығуы функционалдық топтың сәйкес формасына ең маңызды сапалық реакция болып табылады. Бұл реакция пробирка қабырғаларындағы жұқа күміс жабынға байланысты өз атауын алды, бұл реакция кезінде пайда болады.
Оның мәні R-COH альдегидінің аммиак оксидінің ерітіндісімен әрекеттесуінде жатыр.күміс(I), ол еритін күрделі қосылыс болып табылады [Ag(NH3)2]OH және Толленс реактиві деп аталады. Реакция судың қайнау температурасына жақын температурада (80-100 ° C) жүзеге асырылады. Бұл жағдайда альдегидтер сәйкес карбон қышқылдарына дейін тотығады, ал тотықтырғыш металл күміске дейін тотықсызданады, ол тұнбаға түседі.
Реагенттерді дайындау
Альдегидтердегі -SON тобын сапалық анықтау үшін алдымен күміс комплексті қосылыс дайындалады. Ол үшін пробиркаға судағы аздаған аммиак ерітіндісін (аммоний гидроксиді) құяды, содан кейін аз мөлшерде күміс нитраты құйылады. Бұл жағдайда күміс оксидінің пайда болған тұнбасы бірден жоғалады:
2AgNO3 + 2NH3 + H2O -> Ag 2O↓ + 2NH4NO3
Ag2O + 4NΗ3 + Η2O -> 2[Ag (NΗ3)2]ОΗ
Сенімді нәтижелерді сілтімен дайындалған Tollens реактиві береді. Ол үшін 1 г AgNO3 10 г тазартылған суда ерітіліп, оған тең көлемде концентрлі натрий гидроксиді қосылады. Нәтижесінде Ag2O тұнбасы пайда болады, ол концентрацияланған аммоний гидроксиді ерітіндісін қосқанда жоғалады. Реакция үшін тек жаңадан дайындалған реагентті пайдалану керек.

Реакция механизмі
Күміс айна реакциясы мына теңдеуге сәйкес келеді:
2[Ag(NΗ3)2]OΗ + НСОΗ-> 2Ag↓ + ΗCOONΗ4 + 3NΗ3 + H2O
Алдегидтер үшін бұл әрекеттесу жеткілікті түрде зерттелмегенін атап өткен жөн. Бұл реакцияның механизмі белгісіз, бірақ радикалды немесе иондық тотығу нұсқасы болжанады. Диамминдікүміс гидроксиді диолдың күміс тұзының түзілуімен қосылуға ұшырауы мүмкін, содан кейін күміс бөлініп, карбон қышқылын түзеді.
Тәжірибенің сәтті өтуі үшін қолданылатын ыдыстардың тазалығы өте маңызды. Себебі, тәжірибе кезінде түзілген коллоидты күміс бөлшектері шыны бетіне жабысып, айна бетін жасау керек. Кішкене ластану болса, ол сұр түсті флокулентті тұнба түрінде тұнбаға түседі.
Ыдысты тазалау үшін сілті ерітінділерін пайдалану керек. Сонымен, осы мақсаттар үшін NaOH ерітіндісін алуға болады, оны көп мөлшерде тазартылған сумен жуу керек. Шыны бетінде май және механикалық бөлшектер болмауы керек.
Мыс гидроксидімен тотығу
Альдегидтердің мыс (II) гидроксидімен тотығу реакциясы да функционалдық топтың түрін анықтауда айтарлықтай тиімді және тиімді. Ол реакциялық қоспаның қайнауына сәйкес температурада жүреді. Сонымен бірге альдегидтер Фелинг реагентіндегі (жаңадан дайындалған Cu(OH)2 ерітіндісіндегі) екі валентті мысты бір валентті мысқа дейін төмендетеді. Олардың өздері С-Н байланысына оттегі атомының енуіне байланысты тотығады (С тотығу дәрежесі +1-ден +3-ке дейін өзгереді).
Қозғалыстың артында визуалдыреакцияларды ерітінділер қоспасының түсін өзгерту арқылы байқауға болады. Мыс гидроксидінің көкшіл тұнбасы бір валентті мыс гидроксидіне сәйкес бірте-бірте сарыға айналады және одан әрі ашық қызыл түсті тұнба Cu2O.
пайда болады.
Бұл процесс реакция теңдеуіне сәйкес келеді:
R-SLEEP + Cu2+ + NaOH + H2O -> R-COONa + Cu 2O + 4H+

Джонс реагентімен әрекет
Осындай реагент альдегидтерге жақсы әсер ететінін атап өткен жөн. Бұл жағдайда тотығу қыздыруды қажет етпейді және 0-20 °С температурада жеткілікті қысқа уақыт ішінде жүзеге асырылады, ал өнімдердің шығымы 80% -дан жоғары. Джонс реагентінің негізгі кемшілігі - басқа функционалды топтар үшін жоғары селективтіліктің болмауы, сонымен қатар қышқыл орта кейде изомерленуге немесе жойылуға әкеледі.
Джонс реактиві - сұйылтылған күкірт қышқылы мен ацетондағы хром (VI) оксидінің ерітіндісі. Оны натрий бихроматынан да алуға болады. Альдегидтер тотыққанда осы реагенттің әсерінен карбон қышқылдары түзіледі.
Өндірістік оттегінің тотығуы
Өнеркәсіпте сірке альдегидінің тотығуы катализаторлардың - кобальт немесе марганец иондарының қатысуымен оттегінің әсерінен жүзеге асады. Алдымен персірке қышқылы түзіледі:
CH3-ҰЙҚЫ + O2 -> CH3-UNOH
Ол, өз кезегінде, сірке альдегидінің екінші молекуласымен және пероксид арқылы әрекеттеседі.қосылыс сірке қышқылының екі молекуласын береді:
CH3-COOH + CH3-SON -> 2CH3-COOH
Тотығу 60-70 °C температурада және 2 105 Па.
қысымда жүргізіледі.
Йод ерітіндісімен әрекеттесу
Альдегидтік топтардың тотығуы үшін кейде сілтінің қатысуымен йод ерітіндісі қолданылады. Бұл реагент көмірсулардың тотығу процесінде ерекше маңызға ие, өйткені ол өте таңдамалы әрекет етеді. Осылайша, оның әсерінен D-глюкоза D-глюкон қышқылына айналады.
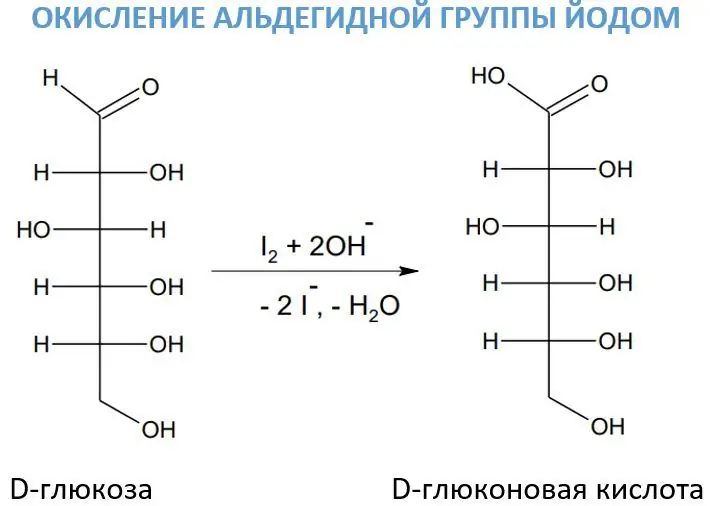
Йод сілтілердің қатысуымен гипоиодид (өте күшті тотықтырғыш) түзеді:.
Гипиодид әсерінен формальдегид метан қышқылына айналады: ΗСОΗ + NaIO + NaOΗ -> ΗCOONa + NaI + H2O.
Альдегидтердің йодпен тотығуы аналитикалық химияда ерітінділердегі олардың сандық құрамын анықтау үшін қолданылады.
Селений диоксидімен тотығу
Алдыңғы реагенттерге қарағанда, селен диоксидінің әсерінен альдегидтер дикарбонилді қосылыстарға айналады, ал формальдегидтен глиоксал түзіледі. Метилен немесе метил топтары карбонилдің жанында орналасса, онда олар карбонилге айналуы мүмкін. SeO2 үшін еріткіш ретінде әдетте диоксан, этанол немесе ксилол қолданылады.
Бір әдіс бойынша реакция араластырғышқа, термометрге және кері тоңазытқышқа қосылған үш мойынды колбада жүргізіледі. Бастапқы затқа 0,25 моль мөлшерінде алынған ерітінді тамшылап қосылады180 мл диоксандағы 0,25 моль селен диоксиді, сондай-ақ 12 мл H2O. Температура 20 °C-тан аспауы керек (қажет болса колбаны суытыңыз). Осыдан кейін, үнемі араластыра отырып, ерітінді 6 сағат бойы қайнатылады. Содан кейін ыстық ерітіндіні сүзеді, селенді бөледі және тұнбаны диоксанмен жуады. Еріткіштің вакуумдық дистилляциясынан кейін қалдық фракцияланады. Негізгі фракция кең температура диапазонында (20-30 °C) алынады және қайта түзетіледі.
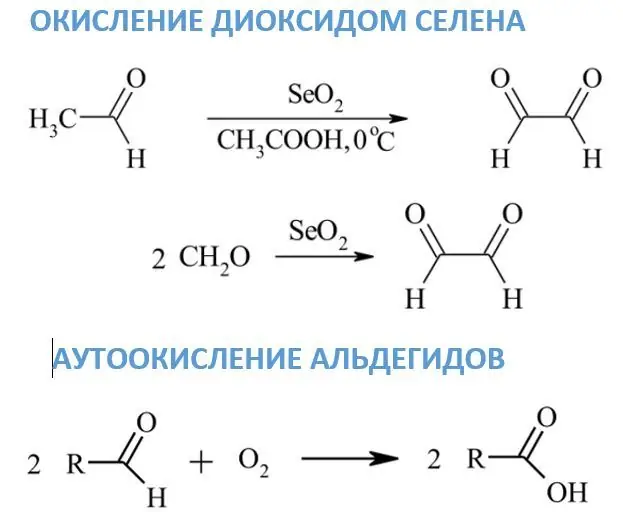
Альдегидтердің автототығуы
Атмосфералық оттегінің әсерінен бөлме температурасында альдегидтердің тотығуы өте баяу жүреді. Бұл реакциялардың негізгі өнімдері сәйкес карбон қышқылдары болып табылады. Автототығу механизмі этаналдың сірке қышқылына өнеркәсіптік тотығуымен байланысты. Аралық заттардың бірі басқа альдегид молекуласымен әрекеттесетін перқышқыл.
Реакцияның бұл түрі жарықпен, асқын тотықтармен, ауыр металдардың ізімен жылдамдатылатындығына байланысты оның радикалды механизмі туралы қорытынды жасауға болады. Су ерітінділеріндегі формальдегид ауада аналогтарына қарағанда әлдеқайда нашар тотығады, өйткені оларда гидратталған метиленгликоль түрінде болады.

Альдегидтердің калий перманганатымен тотығуы
Бұл реакция қышқыл ортада ең сәтті. Оның өтуін визуалды түрде калий перманганатының ерітіндісінің қызғылт түсінің қарқындылығының жоғалуы және толық түссізденуі арқылы бағалауға болады. Реакция мына жерде жүредібөлме температурасы және қалыпты қысым, сондықтан ол арнайы шарттарды қажет етпейді. Пробиркаға 2 мл формальдегид пен күкірт қышқылымен қышқылдандырылған калий перманганатының 1 мл ерітіндісін құйса жеткілікті. Реагенттерді араластыру үшін пробирканы ерітіндімен ақырын шайқаңыз:
5CH3-ҰЙҚЫ + 2KMnO4 + 3H2SO 4 =5CH3-COOH + 2MnSO4 + K2SO 4 + 3H2O
Егер бірдей реакция жоғары температурада жүргізілсе, онда метанал оңай көмірқышқыл газына дейін тотығады:
5CH3-ҰЙҚЫ + 4KMnO4 + 6H2SO 4 =5SO2 + 4MnSO4 + 2K2SO 4 + 11Н2O






