Физикадағы термодинамикалық жүйелерді зерттеудегі маңызды сұрақтардың бірі - бұл жүйе қандай да бір пайдалы жұмыстарды орындай алады ма деген сұрақ. Жұмыс ұғымымен тығыз байланысты ішкі энергия ұғымы. Бұл мақалада идеал газдың ішкі энергиясы қандай екенін қарастырамыз және оны есептеу формулаларын береміз.
Идеал газ
Газ туралы, оған сыртқы әсер ету кезінде ешқандай серпімділік күші болмайтын және соның салдарынан көлемі мен пішінін сақтамайтын агрегаттық күй ретінде әрбір мектеп оқушысы біледі. Көптеген адамдар үшін идеалды газ тұжырымдамасы түсініксіз және түсініксіз болып қала береді. Түсіндірейік.
Идеал газ дегеніміз келесі екі маңызды шартты қанағаттандыратын кез келген газ:
- Оны құрайтын бөлшектердің өлшемі жоқ. Олардың өлшемдері бар, бірақ олардың арасындағы қашықтықтармен салыстырғанда өте кішкентай, сондықтан оны барлық математикалық есептеулерде елемеуге болады.
- Бөлшектер бір-бірімен ван-дер-Ваальс күштерін немесе күштерін қолданып әрекеттеспейдібасқа табиғат. Шындығында, барлық нақты газдарда мұндай әрекеттесу бар, бірақ оның энергиясы кинетикалық бөлшектердің орташа энергиясымен салыстырғанда шамалы.
Сипатталған шарттарды температуралары 300 К-ден жоғары және қысымдары бір атмосферадан аспайтын барлық дерлік нақты газдар қанағаттандырады. Тым жоғары қысымдар мен төмен температуралар үшін газдардың идеалды мінез-құлықтан ауытқуы байқалады. Бұл жағдайда нақты газдар туралы айтылады. Олар Ван дер Ваальс теңдеуі арқылы сипатталған.
Идеал газдың ішкі энергиясы туралы түсінік
Анықтамаға сәйкес жүйенің ішкі энергиясы бұл жүйедегі кинетикалық және потенциалдық энергиялардың қосындысы болып табылады. Егер бұл концепция идеал газға қолданылса, онда потенциалды құраушыны алып тастау керек. Шынында да, идеал газдың бөлшектері бір-бірімен әрекеттеспейтіндіктен, оларды абсолютті вакуумда еркін қозғалады деп санауға болады. Зерттелетін жүйеден бір бөлшекті алу үшін өзара әсерлесудің ішкі күштеріне қарсы жұмыс істеу қажет емес, өйткені бұл күштер жоқ.
Осылайша, идеал газдың ішкі энергиясы әрқашан оның кинетикалық энергиясымен сәйкес келеді. Соңғысы, өз кезегінде, жүйе бөлшектерінің молярлық массасымен, олардың санымен, сондай-ақ ілгерілемелі және айналмалы қозғалыстың орташа жылдамдығымен бірегей түрде анықталады. Қозғалыс жылдамдығы температураға байланысты. Температураның жоғарылауы ішкі энергияның артуына әкеледі және керісінше.
Формулаішкі энергия
Идеал газ жүйесінің ішкі энергиясын U әрпімен белгілеңіз. Термодинамика бойынша ол жүйенің H энтальпиясы мен қысым мен көлемнің көбейтіндісі арасындағы айырмашылық ретінде анықталады, яғни:
U=H - pV.
Жоғарыдағы абзацта біз U мәні барлық газ бөлшектерінің Ekтолық кинетикалық энергиясына сәйкес келетінін білдік:
U=Ek.
Статистикалық механикадан идеал газдың молекулалық-кинетикалық теориясының (МКТ) шеңберінде бір бөлшектің орташа кинетикалық энергиясы Ek1 тең болатыны шығады. келесі мән:
Ek1=z/2kBT.
Мұнда kB және Т - Больцман тұрақтысы мен температурасы, z - еркіндік дәрежелерінің саны. Ek жүйесінің толық кинетикалық энергиясын Ek1 жүйесіндегі N бөлшектерінің санына көбейту арқылы алуға болады:
Ek=NEk1=z/2NkBT.
Осылайша абсолютті температура мен тұйық жүйедегі бөлшектердің саны бойынша жалпы түрде жазылған идеал газдың ішкі энергиясының формуласын алдық:
U=z/2NkBT.
Бір атомды және көп атомды газ
Мақаланың алдыңғы абзацында жазылған U формуласы оны практикалық қолдану үшін ыңғайсыз, өйткені N бөлшектерінің санын анықтау қиын. Алайда, егер n зат мөлшерінің анықтамасын ескеретін болсақ, онда бұл өрнекті неғұрлым ыңғайлы түрде қайта жазуға болады:
n=N/NA; R=NAkB=8, 314 Дж/(мольК);
U=z/2nR T.
Еркіндік дәрежелерінің саны z газды құрайтын бөлшектердің геометриясына байланысты. Сонымен, бір атомды газ үшін z=3, өйткені атом тек кеңістіктің үш бағыты бойынша тәуелсіз қозғала алады. Егер газ екі атомды болса, онда z=5, өйткені еркіндіктің үш трансляциялық дәрежесіне тағы екі айналу еркіндік дәрежесі қосылады. Ақырында, кез келген басқа көп атомды газ үшін z=6 (3 ілгерілемелі және 3 айналмалы еркіндік дәрежесі). Осыны ескере отырып, бір атомды, екі атомды және көп атомды идеал газдың ішкі энергиясының формулаларын келесі түрде жаза аламыз:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Ішкі энергияны анықтауға арналған тапсырманың мысалы
100 литрлік цилиндрде 3 атмосфера қысымындағы таза сутегі бар. Берілген шарттарда сутегі идеалды газ деп есептесек, оның ішкі энергиясы қандай екенін анықтау керек.

Жоғарыдағы U формулаларында заттың мөлшері мен газдың температурасы бар. Мәселе жағдайында бұл мөлшерлер туралы мүлдем ештеңе айтылмайды. Есепті шешу үшін әмбебап Клапейрон-Менделеев теңдеуін еске түсіру керек. Оның суретте көрсетілген түрі бар.
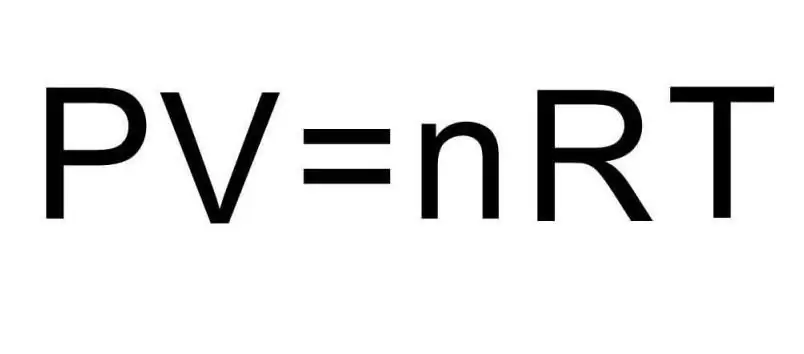
Сутегі H2 екі атомды молекула болғандықтан, ішкі энергия формуласы:
UH2=5/2nRT.
Екі өрнекті салыстыра отырып, мәселені шешудің соңғы формуласына келеміз:
UH2=5/2PV.
Қысым мен көлем бірліктерін шарттан SI бірлік жүйесіне түрлендіру, UH2 формуласындағы сәйкес мәндерді ауыстырып, жауап: UH2 ≈ 76 кДж.






