Идеал газ, күйдің идеал газ теңдеуі, оның температурасы мен қысымы, көлемі… физиканың сәйкес бөлімінде қолданылатын параметрлер мен анықтамалар тізбесін біршама ұзақ жалғастыруға болады. Бүгін біз тек осы тақырыпта сөйлесетін боламыз.
Молекулалық физикада не қарастырылады?

Бұл бөлімде қарастырылатын негізгі объект идеал газ болып табылады. Күйдің идеалды газ теңдеуі қалыпты орта жағдайларын ескере отырып алынды, бұл туралы сәл кейінірек айтамыз. Енді осы "мәселеге" алыстан қарайық.
Газдың біраз массасы бар делік. Оның күйін термодинамикалық сипаттағы үш параметр арқылы анықтауға болады. Бұл, әрине, қысым, көлем және температура. Бұл жағдайда жүйе күйінің теңдеуі сәйкес параметрлер арасындағы қатынас формуласы болады. Ол келесідей көрінеді: F (p, V, T)=0.
Мұнда біз бірінші рет идеал сияқты нәрсенің пайда болуына баяу жақындап келеміз.газ. Молекулалардың өзара әрекеттесуі шамалы болатын газ деп аталады. Жалпы, бұл табиғатта жоқ. Дегенмен, кез келген өте сирек кездесетін газ оған жақын. Қалыпты жағдайда болатын азот, оттегі және ауа идеалдан аз ерекшеленеді. Идеал газдың күй теңдеуін жазу үшін біртұтас газ заңын қолдануға болады. Біз аламыз: pV/T=const.
Байланысты тұжырымдама №1: Авогадро заңы
Ол бізге абсолютті кез келген кездейсоқ газдың бірдей моль санын алып, оларды температура мен қысымды қоса алғанда, бірдей шарттарға қойсақ, онда газдар бірдей көлемді алатынын айта алады. Атап айтқанда, тәжірибе қалыпты жағдайда жүргізілді. Бұл температура 273,15 Кельвин, қысым бір атмосфера (сынаптың 760 миллиметрі немесе 101325 Паскаль) болғанын білдіреді. Осы параметрлермен газ 22,4 литрге тең көлемді алды. Демек, кез келген газдың бір мольі үшін сандық параметрлердің қатынасы тұрақты шама болады деп айта аламыз. Сондықтан бұл санды R әрпімен белгілеп, оны әмбебап газ тұрақтысы деп атауға шешім қабылданды. Осылайша, ол 8,31-ге тең. Бірлік Дж/мольК.
Идеал газ. Күйдің идеалды газ теңдеуі және оның манипуляциясы
Формуланы қайта жазып көрейік. Ол үшін оны мына формада жазамыз: pV=RT. Әрі қарай, біз қарапайым әрекетті орындаймыз, теңдеудің екі жағын да мольдердің ерікті санына көбейтеміз. Біз pVu=uRT аламыз. Молярлық көлемнің көбейтіндісі мен болатынын ескерейікзаттың мөлшері жай ғана көлем болып табылады. Бірақ, ақыр соңында, мольдердің саны бір уақытта масса мен молярлық массаның үлесіне тең болады. Менделеев-Клапейрон теңдеуі дәл осылай көрінеді. Бұл идеал газдың қандай жүйені құрайтыны туралы нақты түсінік береді. Идеал газдың күй теңдеуі келесідей болады: pV=mRT/M.
Қысым формуласын шығарыңыз
Алынған өрнектермен тағы бірнеше манипуляциялар жасайық. Ол үшін Менделеев-Клапейрон теңдеуінің оң жағын Авогадро санына көбейтіп, бөледі. Енді біз Авогадро саны бойынша зат мөлшерінің көбейтіндісін мұқият қарастырамыз. Бұл газдағы молекулалардың жалпы санынан басқа ештеңе емес. Бірақ сонымен бірге әмбебап газ тұрақтысының Авогадро санына қатынасы Больцман тұрақтысына тең болады. Сондықтан қысымның формулаларын былай жазуға болады: p=NkT/V немесе p=nkT. Мұндағы n символы - бөлшектердің концентрациясы.
Идеал газ процестері
Молекулалық физикада изопроцестер деген ұғым бар. Бұл жүйеде тұрақты параметрлердің бірінде жүретін термодинамикалық процестер. Бұл жағдайда заттың массасы да тұрақты болуы керек. Оларды нақтырақ қарастырайық. Сонымен, идеал газ заңдары.
Қысым тұрақты болады
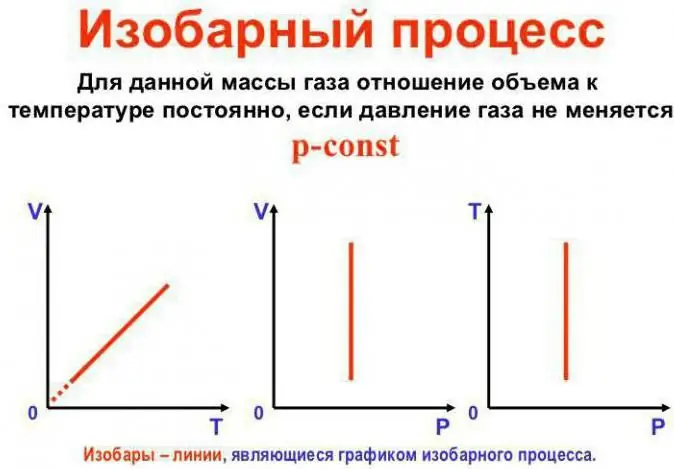
Бұл Гей-Люссак заңы. Ол келесідей көрінеді: V/T=const. Оны басқа жолмен қайта жазуға болады: V=Vo (1 + at). Мұндағы a 1/273,15 К^-1 тең және «көлемнің кеңею коэффициенті» деп аталады. Температураны Цельсийде де, температурада да ауыстыра аламызКельвин шкаласы. Соңғы жағдайда V=Voat формуласын аламыз.
Дыбыс тұрақты болады

Бұл Гей-Люссактың екінші заңы, әдетте Чарльз заңы деп аталады. Ол келесідей көрінеді: p/T=const. Басқа тұжырым бар: p=po (1 + at). Трансформациялар алдыңғы мысалға сәйкес жүзеге асырылуы мүмкін. Көріп отырғаныңыздай, идеал газ заңдары кейде бір-біріне өте ұқсас.
Температура тұрақты болады

Егер идеал газдың температурасы тұрақты болып қалса, онда Бойль-Мариотт заңын алуға болады. Оны былай жазуға болады: pV=const.
Байланысты тұжырымдама №2: ішінара қысым
Бізде газдар бар ыдыс бар делік. Бұл қоспа болады. Жүйе жылулық тепе-теңдік күйінде, ал газдардың өзі бір-бірімен әрекеттеспейді. Мұндағы N молекулалардың жалпы санын білдіреді. N1, N2 және т.б., сәйкесінше, қоспаның әрбір компонентіндегі молекулалар саны. Қысымның p=nkT=NkT/V формуласын алайық. Ол белгілі бір іс үшін ашылуы мүмкін. Екі компонентті қоспа үшін формула келесідей болады: p=(N1 + N2) kT/V. Бірақ содан кейін жалпы қысым әрбір қоспаның парциалды қысымдарынан қосылатыны белгілі болды. Осылайша, ол p1 + p2 сияқты болады және т.б. Бұл ішінара қысымдар болады.
Бұл не үшін?
Алынған формула жүйедегі қысымның молекулалардың әрбір тобынан екенін көрсетеді. Айтпақшы, бұл тәуелді емесбасқалар. Дальтон мұны кейін оның атымен аталып кеткен заңды тұжырымдаған кезде пайдаланды: газдар бір-бірімен химиялық әрекеттеспейтін қоспада жалпы қысым парциалды қысымдардың қосындысына тең болады.






