Термодинамикада жүйенің бастапқы күйінен соңғы күйіне өтуді зерттегенде процестің жылу эффектісін білу маңызды. Жылу сыйымдылығы ұғымы осы әсермен тығыз байланысты. Бұл мақалада біз газдың изохоралық жылу сыйымдылығы нені білдіреді деген сұрақты қарастырамыз.
Идеал газ
Бөлшектері материалдық нүктелер болып есептелетін, яғни өлшемдері жоқ, бірақ массасы бар және барлық ішкі энергиясы тек молекулалар қозғалысының кинетикалық энергиясынан тұратын газды идеал газ деп атайды. және атомдар.
Кез келген нақты газ ешқашан сипатталған үлгіні қанағаттандыра алмайды, өйткені оның бөлшектері әлі де кейбір сызықтық өлшемдерге ие және бір-бірімен әлсіз ван-дер-Ваальс байланыстары немесе басқа түрдегі химиялық байланыстар арқылы әрекеттеседі. Бірақ төмен қысымда және жоғары температурада молекулалар арасындағы қашықтық үлкен, ал олардың кинетикалық энергиясы потенциалдық энергиядан ондаған есе асып түседі. Мұның бәрі нақты газдар үшін тамаша үлгіні жоғары дәлдікпен қолдануға мүмкіндік береді.
Газдың ішкі энергиясы
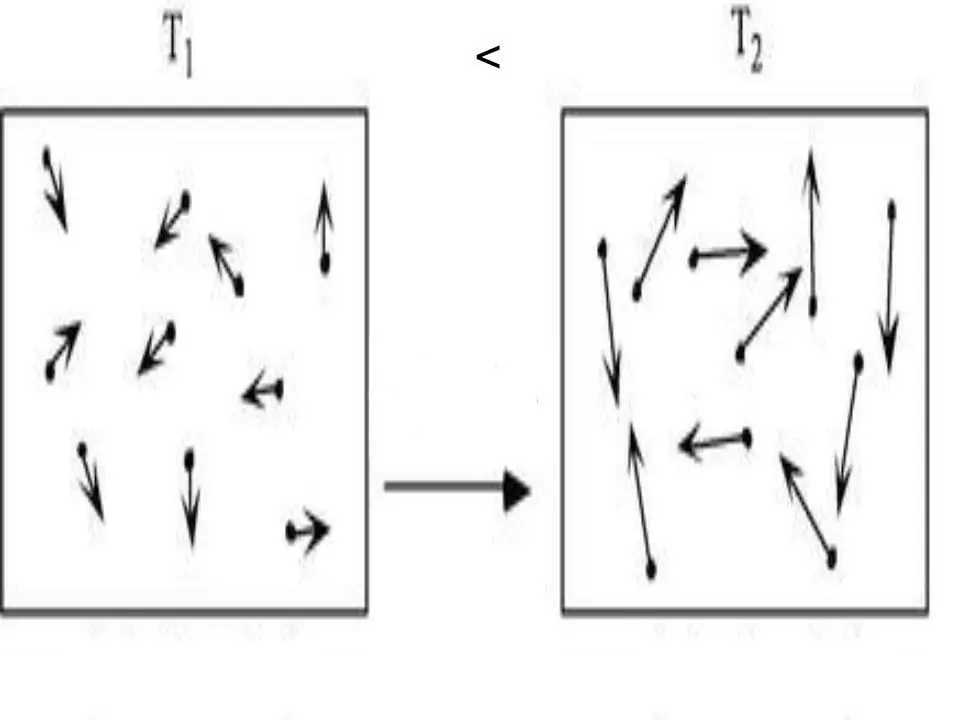
Кез келген жүйенің ішкі энергиясы физикалық сипаттама болып табылады, ол потенциалдық және кинетикалық энергияның қосындысына тең. Идеал газдардағы потенциалдық энергияны елемеуге болатындықтан, олар үшін теңдікті жаза аламыз:
U=Ek.
Мұндағы Ek - кинетикалық жүйенің энергиясы. Молекулярлық-кинетикалық теорияны қолданып және әмбебап Клапейрон-Менделеев күй теңдеуін қолдана отырып, U үшін өрнекті алу қиын емес. Ол төменде жазылған:
U=z/2nRT.
Мұндағы T, R және n сәйкесінше абсолютті температура, газ тұрақтысы және зат мөлшері. z-мәні газ молекуласының еркіндік дәрежелерінің санын көрсететін бүтін сан.
Изобарлық және изохоралық жылу сыйымдылығы
Физикада жылу сыйымдылығы - зерттелетін жүйені бір кельвинге қыздыру үшін оны беру керек жылу мөлшері. Кері анықтама да дұрыс, яғни жылу сыйымдылығы - бір келвин салқындатқанда жүйе бөлетін жылу мөлшері.
Жүйенің ең оңай жолы изохоралық жылу сыйымдылығын анықтау. Ол тұрақты көлемдегі жылу сыйымдылығы деп түсініледі. Жүйе мұндай жағдайларда жұмыс істемейтіндіктен, барлық энергия ішкі энергия қорын көбейтуге жұмсалады. Изохоралық жылусыйымдылықты CV символымен белгілейік, сонда былай жаза аламыз:
dU=CVdT.
Яғни ішкі энергияның өзгеруіжүйе температурасының өзгеруіне тура пропорционал. Бұл өрнекті алдыңғы абзацта жазылған теңдікпен салыстырсақ, идеал газдағы CV формуласына келеміз:
СV=z/2nR.
Бұл мәнді іс жүзінде қолдану ыңғайсыз, себебі ол жүйедегі заттың мөлшеріне байланысты. Сондықтан меншікті изохоралық жылусыйымдылық ұғымы енгізілді, яғни не 1 моль газға, не 1 кг-ға есептелетін шама. Бірінші мәнді CV белгісімен, екіншісін - CV белгісімен белгілейік. м. Олар үшін келесі формулаларды жазуға болады:
CV=z/2R;
CVm=z/2R/M.
Мұндағы M - молярлық масса.
Изобарикалық - жүйеде тұрақты қысымды сақтай отырып, жылу сыйымдылығы. Мұндай процестің мысалы ретінде цилиндрдегі газды қыздырған кезде поршень астындағы газдың кеңеюін келтіруге болады. Изохоралық процесстен айырмашылығы изобарлық процесс кезінде жүйеге берілген жылу ішкі энергияны арттыруға және механикалық жұмыстарды орындауға жұмсалады, яғни:
H=dU + PdV.
Изобарлық процестің энтальпиясы изобарлық жылу сыйымдылығы мен жүйедегі температураның өзгеруінің көбейтіндісі, яғни:
H=CPdT.
Егер 1 моль газдың тұрақты қысымында кеңеюді қарастырсақ, онда термодинамиканың бірінші заңы былай жазылады:
CPdT=CV dT + RdT.
Соңғы мүше теңдеуден алындыКлапейрон-Менделеев. Осы теңдіктен изобарлық және изохоралық жылу сыйымдылықтар арасындағы қатынас шығады:
CP=CV + R.
Идеал газ үшін тұрақты қысымдағы меншікті молярлық жылу сыйымдылығы әрқашан R=8, 314 Дж/(мольК) сәйкес изохоралық сипаттамадан жоғары болады.
Молекулалардың еркіндік дәрежесі және жылу сыйымдылығы
Меншікті молярлық изохоралық жылу сыйымдылығының формуласын қайта жазайық:
CV=z/2R.
Бір атомды газ жағдайында z=3 мәні, өйткені кеңістіктегі атомдар тек үш тәуелсіз бағытта қозғала алады.
Егер екі атомды молекулалардан тұратын газ туралы айтатын болсақ, мысалы, оттегі O2 немесе сутегі H2, онда, трансляциялық қозғалысқа қосымша, бұл молекулалар әлі де екі өзара перпендикуляр осьтің айналасында айнала алады, яғни z 5-ке тең болады.
Күрделі молекулалар үшін z=6 пайдаланыңыз.V
анықтау үшін






