Физикадағы анықтамаларды білу әртүрлі физикалық есептерді сәтті шешудің негізгі факторы болып табылады. Мақалада идеал газ жүйесі үшін изобарлық, изохоралық, изотермиялық және адиабаталық процестердің нені білдіретінін қарастырамыз.
Идеал газ және оның теңдеуі
Изобарлық, изохоралық және изотермиялық процестерді сипаттауға кіріспес бұрын, идеал газдың не екенін қарастырайық. Физикадағы бұл анықтама бойынша олар барлық бағытта жоғары жылдамдықпен қозғалатын өлшемсіз және өзара әрекеттеспейтін бөлшектердің үлкен санынан тұратын жүйені қарастырады. Шын мәнінде, біз атомдар мен молекулалар арасындағы қашықтық олардың өлшемдерінен әлдеқайда асатын және кинетикалық энергиямен салыстырғанда бөлшектердің өзара әрекеттесуінің потенциалдық энергиясы өзінің кішігірімдігіне байланысты ескерілмейтін заттың газ тәрізді агрегаттық күйі туралы болып отыр..
Идеал газдың күйі - оның термодинамикалық параметрлерінің жиынтығы. Негізгілері температура, көлем және қысым. Оларды сәйкесінше T, V және P әріптерімен белгілейік. XIX ғасырдың 30-жылдарындаКлапейрон (француз ғалымы) алдымен бір теңдік шегінде көрсетілген термодинамикалық параметрлерді біріктіретін теңдеуді жазды. Мынадай көрінеді:
PV=nRT,
мұндағы n және R сәйкесінше заттардың саны және газ тұрақтысы.
Газдардағы изопроцестер дегеніміз не?
Көпшілік байқағандай, изобарлық, изохоралық және изотермиялық процестер өз атауларында бірдей "iso" префиксін пайдаланады. Ол бүкіл процестің өтуі кезінде бір термодинамикалық параметрдің теңдігін білдіреді, ал қалған параметрлер өзгереді. Мысалы, изотермиялық процесс нәтижесінде жүйенің абсолютті температурасы тұрақты сақталатынын көрсетеді, ал изохоралық процесс тұрақты көлемді көрсетеді.
Изопроцестер зерттеуге ыңғайлы, өйткені термодинамикалық параметрлердің бірін бекіту газ күйінің жалпы теңдеуін жеңілдетуге әкеледі. Барлық осы изопроцестер үшін газ заңдары эксперименталды түрде ашылғанын атап өту маңызды. Олардың талдауы Клапейронға қысқартылған әмбебап теңдеуді алуға мүмкіндік берді.
Изобарлық, изохоралық және изотермиялық процестер
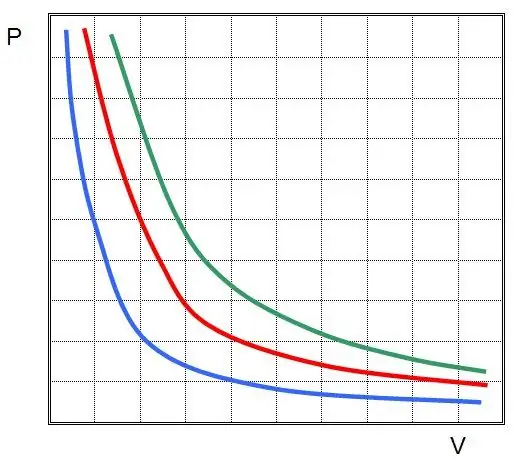
Бірінші заң идеал газдағы изотермиялық процесс үшін ашылды. Қазір ол Бойль-Мариот заңы деп аталады. T өзгермейтіндіктен, күй теңдеуі теңдікті білдіреді:
PV=тұрақты.
Басқаша айтқанда, жүйедегі қысымның кез келген өзгерісі, егер газдың температурасы тұрақты түрде сақталса, оның көлемінің кері пропорционалды өзгеруіне әкеледі. P(V) функциясының графигігипербола.
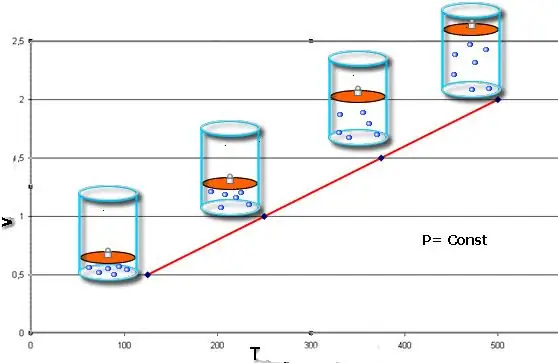
Изобарлық процесс - бұл қысым тұрақты болып қалатын жүйе күйінің өзгеруі. Клапейрон теңдеуіндегі P мәнін бекітіп, келесі заңды аламыз:
V/T=тұрақты.
Бұл теңдік 18 ғасырдың аяғында оны алған француз физигі Жак Шарльдің есімімен аталады. Изобар (V(T) функциясының графикалық көрінісі) түзу сызыққа ұқсайды. Жүйедегі қысым неғұрлым көп болса, бұл сызық соғұрлым тез көтеріледі.
Газ поршень астында қыздырылса, изобарлық процесті орындау оңай. Соңғысының молекулалары жылдамдығын арттырады (кинетикалық энергия), поршеньге жоғары қысым жасайды, бұл газдың кеңеюіне және P тұрақты мәнін сақтауға әкеледі.
Соңында, үшінші изопроцесс изохоралық болып табылады. Ол тұрақты көлеммен жұмыс істейді. Күй теңдеуінен сәйкес теңдікті аламыз:
P/T=тұрақты.
Физиктер арасында Гей-Люссак заңы ретінде белгілі. Қысым мен абсолютті температура арасындағы тура пропорционалдық изобаралық процестің графигі изобарлық граф сияқты оң көлбеу түзу екенін көрсетеді.
Барлық изопроцестер жабық жүйелерде болатынын түсіну маңызды, яғни n мәні олардың жүру барысында сақталады.
Адиабаталық процесс
Бұл процесс «iso» санатына жатпайды, өйткені оның өтуі кезінде барлық үш термодинамикалық параметр өзгереді. адиабаттықсыртқы ортамен жылу алмасатын жүйенің екі күйі арасындағы ауысу деп аталады. Осылайша, жүйенің кеңеюі оның ішкі энергия қоры есебінен жүзеге асырылады, бұл ондағы қысымның және абсолютті температураның айтарлықтай төмендеуіне әкеледі.
Идеал газ үшін адиабаталық процесс Пуассон теңдеулерімен сипатталады. Олардың бірі төменде көрсетілген:
PVγ=const,
мұндағы γ - тұрақты қысымдағы және тұрақты көлемдегі жылу сыйымдылықтарының қатынасы.
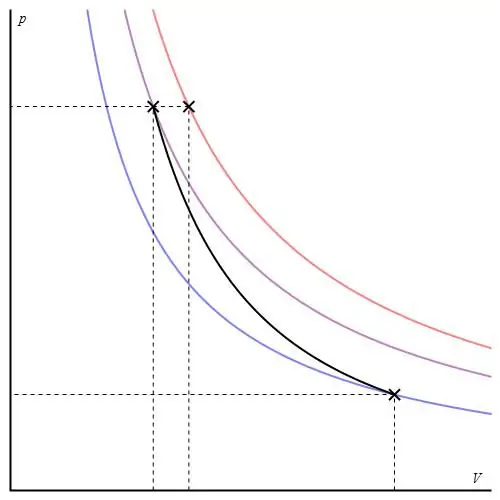
Адиабаталық график изохоралық процесс графигінен және изобарлық графиктен ерекшеленеді, бірақ ол гиперболаға (изотерма) ұқсас. P-V осьтеріндегі адиабат изотермаға қарағанда қаттырақ әрекет етеді.






