Талдаудың кондуктометриялық әдісі химиялық реакцияның барысын бақылау үшін электролиттік өткізгішті өлшеу болып табылады. Бұл ғылым аналитикалық химияда кеңінен қолданылады, мұнда титрлеу стандартты операция әдісі болып табылады. Кондуктометрия дегеніміз не? Аналитикалық химиядағы жалпы тәжірибеде бұл термин титрлеудің синонимі ретінде қолданылады, сонымен бірге ол титрленбейтін қолданбаларды сипаттау үшін қолданылады. Бұл талдау әдісін қолданудың қандай пайдасы бар? Ол көбінесе ерітіндінің жалпы өткізгіштігін анықтау немесе иондардың қатысуымен титрлеудің соңғы нүктесін талдау үшін қолданылады.
Тарих
Өткізгіштік өлшемдер 18 ғасырда Андреас Баумгартнер Бад Гаштейн жеріндегі тұзды және минералды суларды байқаған кезде басталды. Австрия электр тогын өткізеді. Осылайша, суды тазарту жүйелерінің тиімділігін тексеру үшін бүгінгі күні жиі қолданылатын судың тазалығын анықтау үшін бұл әдісті қолдану 1776 жылы басталды. Осылайша талдаудың кондуктометриялық әдісінің тарихы басталды.
Фридрих Колрауш бұл ғылымның дамуын 1860 жылдары суға, қышқылдарға және басқа ерітінділерге айнымалы ток қолданған кезде жалғастырды. Шамамен осы уақытта күкірт қышқылы мен хром сульфаты кешендерінің өзара әрекеттесуін зерттеген Уиллис Уитни бірінші кондуктометриялық соңғы нүктені тапты. Бұл нәтижелер потенциометриялық титрлеумен және 1883 жылы Роберт Берендтің хлорид пен бромид HgNO3 титрлеудегі көлемдік талдаудың бірінші құралымен аяқталды. Осылайша, қазіргі заманғы кондуктометриялық талдау әдісі Берендке негізделген.
Бұл әзірлеме тұздардың ерігіштігін және сутегі иондарының концентрациясын, сондай-ақ қышқыл-негіз және тотығу-тотықсыздану титрлерін тексеруге мүмкіндік берді. Кондуктометриялық талдау әдісі 1909 жылы басталған шыны электродтың дамуымен жетілдірілді.
Титрлеу
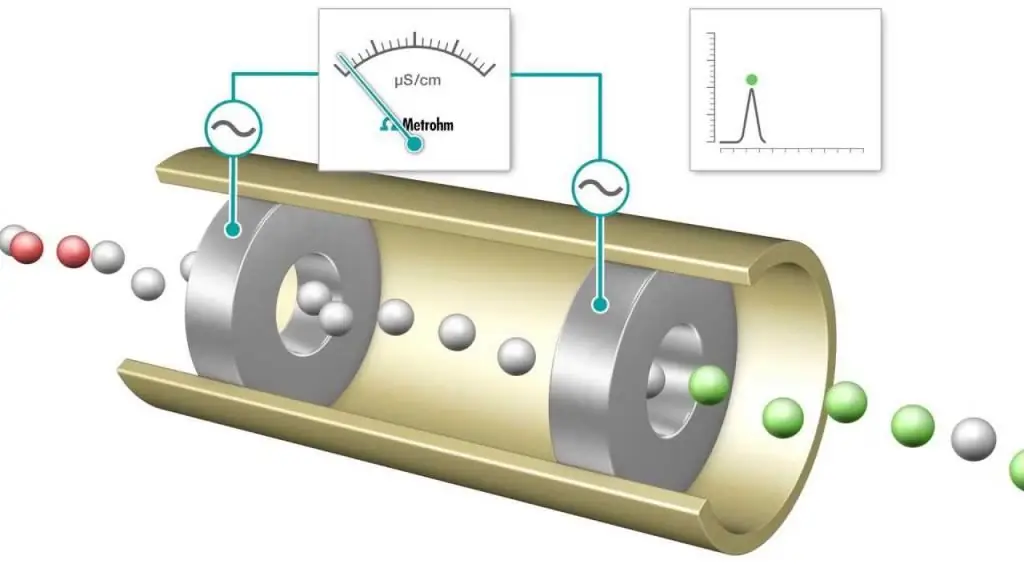
Кондуктометриялық титрлеу - бір реагент қосу арқылы реакциялық қоспаның электролиттік өткізгіштігі үздіксіз бақыланатын өлшем. Эквиваленттік нүкте - өткізгіштік кенет өзгеретін нүкте. Өткізгіштіктің айтарлықтай жоғарылауы немесе төмендеуі екі ең жоғары өткізгіш иондардың, сутегі мен гидроксид иондарының концентрациясының өзгеруімен байланысты. Бұл әдіскәдімгі индикаторлармен қолдануға болмайтын түсті ерітінділерді немесе біртекті суспензияны (мысалы, ағаш массасының суспензиясы) титрлеу үшін пайдалануға болады.
Қышқылдық-негіздік және тотығу-тотықсыздану титрлеулері жиі орындалады, олар соңғы нүктені анықтау үшін жалпы индикаторларды пайдаланады, мысалы, метил-апельсин, қышқыл-негіздік титрлеу үшін фенолфталеин және йодометриялық типтегі тотығу-тотықсыздану процесі үшін крахмал ерітінділері. Дегенмен, электр өткізгіштік өлшемдерін соңғы нүктені анықтау құралы ретінде де пайдалануға болады, мысалы, күшті негіз NaOH бар HCl ерітіндісін бақылау кезінде.
Протонды бейтараптандыру
Титрлеу барысында протондар су түзу арқылы NaOH түзу үшін бейтараптандырылады. Қосылған әрбір NaOH мөлшері үшін сутегі иондарының эквивалентті саны жойылады. Іс жүзінде жылжымалы H+ катионы аз қозғалмалы Na+ ионымен ауыстырылады және титрленген ерітіндінің өткізгіштігі, сондай-ақ өлшенген жасуша өткізгіштігі төмендейді. Бұл натрий хлоридінің NaCl ерітіндісін алуға болатын эквиваленттік нүктеге жеткенше жалғасады. Көбірек негіз қосылса, Na+ және OH- иондары көбірек қосылатындықтан артады және бейтараптандыру реакциясы бұдан былай H+ айтарлықтай мөлшерін алып тастамайды.

Демек, күшті қышқылды күшті негізмен титрлегенде, эквиваленттік нүктеде өткізгіштік минимумға ие болады. Бұл минимумтитрлеудің соңғы нүктесін анықтау үшін индикаторлық бояудың орнына қолдануға болады. Титрлеу қисығы - NaOH ерітіндісінің қосылған көлеміне байланысты өткізгіштіктің немесе өткізгіштіктің өлшенген мәндерінің графигі. Титрлеу қисығын графикалық түрде эквиваленттік нүктені анықтау үшін пайдалануға болады. Кондуктометриялық талдау әдісі (және оны пайдалану) қазіргі химияда өте өзекті.
Реакция
Әлсіз қышқыл-әлсіз негіз арасындағы реакция үшін электр өткізгіштік алдымен аздап төмендейді, өйткені қол жетімді H+ иондары аз. Содан кейін өткізгіштік эквиваленттік нүктенің көлеміне дейін аздап артады, бұл тұз катионы мен анионның үлесіне байланысты (күшті қышқылдық негіз жағдайында бұл үлес елеусіз және ол жерде қарастырылмайды.) Эквиваленттік нүктеге жеткеннен кейін., өткізгіштік OH иондарының артық болуына байланысты тез артады.
Өткізгіштік детекторлары (кондуктометриялық талдау әдісі) су ерітінділеріндегі электролит концентрациясын өлшеу үшін де қолданылады. Ерітіндінің өткізгіштігін тудыратын талданатын заттың молярлық концентрациясын ерітіндінің өлшенген электр кедергісі арқылы алуға болады.
Кондуктометриялық талдау әдісі: принцип және формулалар
(2.4.13) C=Constcell1Λm1Res, мұндағы Constcell - өлшеу ұяшығына байланысты тұрақты мән, Res - құрылғы өлшенетін электр кедергісі (Ом заңы бойынша Res=I / V және тұрақты шамамен). кернеу V өлшеу I қарқындылығы Res) есептеуге мүмкіндік береді, ал Λm - эквивалентиондық бөлшектер үшін өткізгіштік. Практикалық мақсатта Λm тұрақты деп санауға болады, бірақ ол Колрауш заңы бойынша концентрацияға байланысты:
(2.4.14)=Хт Λm0-ΘC, мұндағы Θ - тұрақты шама, ал Λm0 - әрбір ионға тән шекті молярлық өткізгіштік сипаттамасы. Молярлық өткізгіштік, өз кезегінде, температураға байланысты.
Scrit
Өлшемді талдаудың кондуктометриялық әдісінің дамуы ғалымдарды жаңа жаңалықтарға жетеледі. Ғалымдар CI иондарының көзі ретінде алкилхлорид гидролизін қолдана отырып, Ag+ иондарынан асатын біртекті AgCl тұндыру жүйесінде кондуктометрияны пайдаланып, Скриттің аса қанығу коэффициентін анықтады. Олар 15, 25 және 35°C температурада сәйкесінше Scrit=1,51, 1,73 және 1,85 тапты, мұнда олардың анықтамасы бойынша S=([Ag+][Cl-] / Ksp) 1/2. Егер аса қанығу факторының бұл анықтамасы біздікіне (S=[Ag+][Cl-] / Ksp) түрленсе, нәтижелер сәйкесінше 2,28, 2,99 және 3,42 болып табылады, бұл осы зерттеу нәтижелерімен жақсы сәйкес келеді. Дегенмен, Скриттің температураға тәуелділігі осы зерттеуде сипатталғанға қарама-қайшы. Бұл қайшылықтың себебі анық болмаса да, температураның жоғарылауымен Скриттің төмендеуі әбден орынды болуы мүмкін, өйткені ядролану жылдамдығы ΔGm/ кТ аздаған өзгеріспен күрт өзгереді, демек, T пропорционал ΔGm/ кТ. − 3 (lnSm) 2 (1.4.12) формуласы бойынша берілген жүйедегі температураның өзгеруімен дерлік тұрақты деп есептеледі. Айтпақшы, S анықтамасы [Ag +] [Cl -] / Ksp болуы керек, өйткені[AgCl] мономерінің концентрациясы бастапқыда S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp ретінде берілген.
Танака мен Ивасаки
Кондуктометриялық талдау әдісінің тарихын екі әйгілі жапон ғалымы жалғастырды. Танака мен Ивасаки AgCl және AgBr бөлшектерінің нуклеациялану процесін көп арналы спектрофотометрмен үйлестіре отырып тоқтатылған ағын әдісін қолданып зерттеді, бұл мссек тәртібі бойынша жылдам процесті зерттеу үшін пайдалы. Олар 10-4 моль дм-3 ретті AgC104 ерітіндісін KX (X=X=) араластырған кезде біршама тар ультракүлгін жұту жолағы бар кейбір спецификалық күміс галогенді кешені AgXm (m-1) түзілгенін анықтады. Cl немесе Br) 10-2-ден 10-1 моль дм-3-ке дейінгі ретті ерітінді, содан кейін оның 10 мс-ке жуық жылдам ыдырауы, кең ультракүлгін сіңіргіштігі бар және спектрдің әлдеқайда баяу өзгеретін аралық өнім түзілуімен жүреді. аралық өнім. Олар аралық өнімді n молекуладан тұратын монодисперстік өзектер (AgX) n деп түсіндірді және C прекурсорының AgXm (m-1) - (n=7) әртүрлі бастапқы концентрациялары үшін t=0 кезінде -dC/dt α Cn көрінетін қатынасынан n анықталды. AgCl үшін -10, AgBr үшін n=3-4).

Алайда AgXm (m − 1) прекурсоры стационарлы емес түрде ыдырайтындықтан, бұл процесте квазистационарлық ядро түзілу теориясы қолданылмайды және осылайша n-дің алынған мәні мынаған сәйкес келмейді nкритикалық ядролардың мәні. Егер аралық өнімде монодисперсті ядролар n болса,мономерлік кешен арқылы түзілген -dC/dt α C қатынасы сақталмауы мүмкін. Егер n-мерден кіші кластерлер тепе-теңдікте деп есептемесек, ki − 1, ici − 1c1=ki, i − 1ci, бір-бірімен c1 → c2 → c3 →… → cn − 1 → cn., және cn − 1 → cn соңғы қадамы ғана қайтымсыз; яғни c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Сонымен қатар, 2-ден n-1-ге дейінгі кластерлердің концентрацияларында болмашы тепе-теңдік концентрациялары бар деп есептеу керек. Алайда бұл болжамдарды ақтауға негіз жоқ сияқты. Екінші жағынан, біз AgCl19 текше үшін γ=101 мДж m − 2 және текше AgBr20 үшін γ=109 мДж m − 2 пайдаланып, жылдам процестің соңында критикалық ядролардың радиустарын және аса қанығу коэффициенттерін S есептеуге тырыстық, n, AgCl19 үшін 7-10 және AgBr20 үшін 3-4 мәндері монодисперсті ядролардың өлшеміне эквивалентті деп есептесек, n. Кондуктометриялық талдау әдісі, оның шолулары жай мақұлдау мен таңдануға дейін, ғылым ретінде химияны жаңа тудырды.
Нәтижесінде ғалымдар келесі формуланы ашты: n=9 болатын AgCl үшін r=0,451 нм және S=105; n=4 бар AgBr үшін r=0,358 нм және S=1230. Олардың жүйелері 25 °C температурада шамамен 1,7-2,0 AgCl сыни аса қанығуын алған Дэвис пен Джонс жүйелерімен салыстыруға болатындықтан. AgNO3 және KCl сұйылтылған сулы ерітінділерінің тең көлемдерінде тікелей аралас кондуктометрияны қолдану өте жоғары S мәндері нақты асқын қанығу факторларын көрсетпеуі мүмкін.аралық ядролармен тепе-теңдікте.
УК-сіңіру
Ультракүлгін сәулесін сіңіру қабілеті кең аралық өнімді стационарлық емес дәйекті реакция нәтижесінде пайда болатын кең өлшемді таралуы бар орташа ядролардан әлдеқайда үлкенірек деп санау орындырақ сияқты. Аралық ядролардың кейінгі баяу өзгеруі олардың Оствальдта жетілуіне байланысты сияқты.

Жоғарыда келтірілген контексте американдық химик Нильсен де n=dlogJ көмегімен асқын қанығу функциясы ретінде барий сульфаты бөлшектерінің нуклеациялануы үшін 12 шамасында ұқсас nжәне 103-тен жоғары S сәйкес S мәнін шығарды. / dlogC формулаға Бехер-Деринг тәрізді теорияда. (1.3.37), бірақ nорнына (n+ 1) береді. Бұл тәжірибеде барий иондары мен сульфат иондарының ерітінділері тікелей араласқандықтан, жылдам өтпелі нуклеация араласқаннан кейін бірден аяқталуы керек және өлшенген нәрсе Оствальдтың кейінгі баяу жетілуі және/немесе түзілген ядролардың қосылу жылдамдығы болуы мүмкін. Шамасы, бұл n мәнінің негізсіз аз болуының және өте жоғары қанықтырудың себебі болып табылады. Сондықтан, біз тағы да айта кетуіміз керек, мономерлі түрлердің кейбір резервуары, оларды тұтынуға жауап ретінде босатып, жабық жүйеде квазистационарлық нуклеацияға қол жеткізу үшін әрқашан қажет. Нуклеацияның барлық классикалық теориялары, соның ішінде Бехер-Дёринг теориясы мұндай шартты жанама түрде қабылдайды. Кондуктометрияның анықтамасыталдау әдісі жоғарыдағы мақаланың бөлімдерінде берілген.
Басқа ғалымдар құрамында метиленгалогенді және күміс иондары бар судың импульстік радиолизі арқылы күміс галогенидінің өтпелі ядролану процесін зерттеді, оның барысында метиленгалогенид диапазондағы импульстік сәулеленуден туындаған гидратталған электрондар арқылы галогенид иондарын шығару үшін ыдырайды. 4 нс-тен 3 мкс-ке дейін. Өнімдердің спектрлері фотокөбейткіш пен жолақты камераның көмегімен жазылды және мономерлі күміс галогенді прекурсорлар уақыт ішінде микросекундтар тәртібімен түзілетіні анықталды, содан кейін Танака мен Ивасаки бақылағандай нуклеация процесі жүреді. Олардың нәтижелері әрекеттесуші заттарды тікелей араластыру арқылы күміс галогенидтерінің ядролану процесі екі элементар сатыдан тұратынын анық көрсетеді; яғни μs ретті мономерлік прекурсордың түзілуі және одан кейін 10 мс ретті ядроларға ауысуы. Айта кету керек, ядролардың орташа өлшемі шамамен 10 нм.
Қанықтылық
Жауын-шашын бойы желатин ерітіндісіне AgNO3 және KCl сияқты реактивтердің жоғары концентрациясы үздіксіз енгізілетін ашық жүйелердегі AgCl бөлшектерінің ядролануының аса қанығу коэффициенттеріне қатысты, Strong және Wey31 1,029 (80° C) - 1.260 (40°C) және Лейбнер32 60°C температурада AgCl тұқымдық бөлшектерінің критикалық асқын қанығу кезінде өсу жылдамдығын өлшеу нәтижесінде есептелген 1.024 туралы хабарлады. Бұл сандық талдаудың кондуктометриялық әдісінің мәні.
Екінші жағынан, ашық AgBr бөлшектер жүйелері үшін кейбіркритикалық аса қанығу коэффициентінің болжалды мәндері, Scrit: Scrit∼- 1,5 70 °C кезінде Wey және Strong33 бойынша KBr-ге AgNO3 ерітіндісін қосудың әртүрлі жылдамдықтарында ренуклеация шегін табу арқылы анықталатын мөлшерге тәуелді максималды өсу жылдамдығынан. қос ағындар арқылы тұқым бөлшектері бар ерітінді; Скрит=1,2-1,5 25°С-та Джаганнатан және Вей34 бойынша Гиббс-Томсон теңдеуінен анықталған максималды аса қанығу коэффициенті ретінде екі реактивті AgBr жауын-шашынның ядролану сатысы кезінде электронды микроскопия арқылы байқалатын ядролардың минималды орташа өлшемі туралы олардың деректері.. Бұл кондуктометриялық мөлшерлеу әдісін қолданғанда өте тиімді.

Осы Скрит мәндерін есептегенде, олар γ=140 мДж m − 2 алды. Ашық жүйелердегі нуклеация реактивтердің шығатын жерлерінің жанындағы өте жоғары қаныққан жергілікті аймақта пайда болған ядролардың тіршілік ету процесіне сәйкес келетіндіктен, критикалық аса қанығу максималды өлшемді ядролармен тепе-теңдіктегі еріген заттың концентрациясына сәйкес келеді, егер біз текше AgBr (=109 мДж м −2) үшін теориялық γ бар ашық жүйелердегі AgBr ядроларының максималды радиусы туралы Sugimoto35 деректерін қолдансақ (.3 8,3 нм)) 3 болса, онда аса қанығудың критикалық коэффициенті, Скрит, 25°C кезінде 1,36 болатындай есептеледі (егер γ 140 мДж/м2 деп қабылданса, онда Скрит=1,48 болады).
Демек, кез келген жағдайда сыни асқынуларкүміс галогенді бөлшектерінің ашық жүйелері, әдетте, жабық жүйелердегі максималды асқын қанығулардан (мүмкін, критикалық аса қанығуларға жақын) әлдеқайда төмен. Себебі, ашық жүйенің жергілікті аймағында түзілген ядролардың орташа радиусы тұйық жүйедегі rm-ден әлдеқайда үлкен, бұл, мүмкін, ашық жүйенің жергілікті аймағында жоғары концентрацияланған бастапқы ядролардың лезде қосылуынан болуы мүмкін. жергілікті электролит концентрациясы.
Қолданба
Ферменттік процестер кезінде үздіксіз жазу үшін кондуктометриялық титрлеу әдісін қолдану кеңінен зерттелген және талданған. Электрохимиялық аналитикалық әдістердің барлығы дерлік электрохимиялық реакцияларға негізделген (потенциометрия, вольтамметрия, амперометрия, кулометрия).
Талдаудың кондуктометриялық әдісі - электродтарда электрохимиялық реакциялар мүлде болмайтын немесе елемеуге болатын қайталама реакциялар болатын әдіс. Сондықтан бұл әдісте шекаралық қабаттағы электролит ерітіндісінің ең маңызды қасиеті оның электр өткізгіштігі болып табылады, ол биологиялық реакциялардың жеткілікті кең ауқымына сәйкес өзгереді.
Артықшылықтар
Кондуктометриялық биосенсорлардың басқа түрлендіргіштерге қарағанда кейбір артықшылықтары бар. Біріншіден, олар төмен құны бар жұқа пленка стандартты технологиясы арқылы жасалуы мүмкін. Бұл биологиялық материалды иммобилизациялаудың оңтайландырылған әдісін қолданумен қатар, құрылғылардың бастапқы құнының да айтарлықтай төмендеуіне әкеледі.талдаудың жалпы құны. Кірістірілген микробиосенсорлар үшін дифференциалды өлшеу режимін орындау оңай, ол сыртқы әсерлерді өтейді және өлшеу дәлдігін айтарлықтай жақсартады.
Деректер кондуктометриялық биосенсорлардың үлкен әлеуетін анық көрсетеді. Дегенмен, бұл әлі де биосенсорлардағы айтарлықтай жаңа тренд, сондықтан коммерциялық құрылғыны әзірлеудің болашағы зор.
Жаңа әдістер
Кейбір ғалымдар өткізгіштік арқылы pKa өлшеудің жалпы әдісін сипаттады. Бұл әдіс шамамен 1932 жылға дейін кеңінен қолданылды (рН өлшеу әдістері қолданылғанға дейін). Кондуктометриялық әдіс температураға өте сезімтал және қабаттасатын pKa мәндерін өлшеу үшін қолданыла алмайды. Хромофоры жоқ үлгілер үшін ықтимал артықшылық оны 2,8 × 10-5 М-ге дейін өте сұйылтылған ерітінділерде қолдануға болады. Соңғы жылдары кондуктометрия 87 лидокаиннің рКа-сын өлшеу үшін пайдаланылды, бірақ алынған нәтиже 0,7 болды. жалпы қабылданған рН мәнінен төмен бірлікке.

Альберт пен Сержант сонымен қатар ерігіштік өлшемдерінен pKa анықтау әдісін сипаттады. Жоғарыда айтылғандай, ерігіштік pKa-ға тәуелді, сондықтан ерігіштік қисық сызықта бірнеше рН мәндерінде өлшенсе, pKa анықтауға болады. Пек пен Бенет ерігіштік пен рН өлшемдерінің жиынтығын ескере отырып, монопротикалық, дипротикалық және амфотерлі заттар үшін pKa мәндерін бағалаудың жалпы әдісін сипаттады. Хансен мен Гафлигер үлгінің pKa-сын алды, олайналмалы дискі құрылғысындағы рН функциясы ретінде бастапқы еру жылдамдығынан гидролиз арқылы тез ыдырайды. Нәтиже pH/UV нәтижесімен жақсы сәйкес келеді, бірақ ыдырау соңғы әдісті қиындатады. Бұл, жалпы алғанда, талдаудың кондуктометриялық әдісінің сипаттамасы.






