Әр адам өз өмірінде материяның үш жиынтық күйінің бірінде болатын денелерді кездестіреді. Агрегацияның ең қарапайым күйі - бұл газ. Мақалада идеал газ түсінігін қарастырамыз, жүйе күйінің теңдеуін береміз, сонымен қатар абсолютті температураның сипаттамасына біраз көңіл бөлеміз.
Заттың газ күйі
Әр оқушы «газ» сөзін естігенде заттың қандай күйі туралы айтып жатқанын жақсы түсінеді. Бұл сөз өзіне берілген кез келген көлемді алуға қабілетті дене деп түсініледі. Ол өзінің пішінін сақтай алмайды, өйткені ол тіпті ең кішкентай сыртқы әсерге қарсы тұра алмайды. Сондай-ақ, газ көлемін сақтамайды, бұл оны қатты заттардан ғана емес, сонымен қатар сұйықтардан да ажыратады.
Сұйық сияқты, газ да сұйық зат. Газдардағы қатты денелердің қозғалысы процесінде соңғылары бұл қозғалысқа кедергі жасайды. Нәтижесінде пайда болатын күш кедергі деп аталады. Оның мәні тәуелдідененің газдағы жылдамдығы.
Газдардың күшті мысалдары: ауа, үйлерді жылытуға және тамақ дайындауға арналған табиғи газ, жарнамалық жарқырау түтіктерін толтыру үшін пайдаланылатын немесе дәнекерлеу кезінде инертті (агрессивті емес, қорғаныш) орта жасау үшін қолданылатын инертті газдар (Ne, Ar).
Идеал газ
Газ заңдары мен күй теңдеуін сипаттауға кіріспес бұрын, идеал газ деген не деген сұрақты жақсы түсіну керек. Бұл ұғым молекулалық-кинетикалық теорияға (МКТ) енгізілген. Идеал газ дегеніміз келесі сипаттамаларды қанағаттандыратын кез келген газ:
- Оны құрайтын бөлшектер тікелей механикалық соқтығыстарды қоспағанда бір-бірімен әрекеттеспейді.
- Бөлшектердің ыдыстың қабырғаларымен немесе өзара соқтығысуы нәтижесінде олардың кинетикалық энергиясы мен импульсі сақталады, яғни соқтығыс абсолютті серпімді болып саналады.
- Бөлшектердің өлшемдері жоқ, бірақ шекті массасы бар, яғни олар материалдық нүктелерге ұқсас.
Кез келген газ идеалды емес, шынайы болатыны заңдылық. Осыған қарамастан, көптеген практикалық есептерді шешу үшін бұл жуықтаулар әбден жарамды және қолдануға болады. Жалпы эмпирикалық ереже бар: химиялық табиғатына қарамастан, егер газдың температурасы бөлме температурасынан жоғары болса және қысымы атмосфералық немесе одан төмен болса, оны жоғары дәлдікпен идеалды деп санауға болады және оны сипаттау үшін қолдануға болады. ол.күйдің идеал газ теңдеуінің формуласы.
Клапейрон-Менделеев заңы
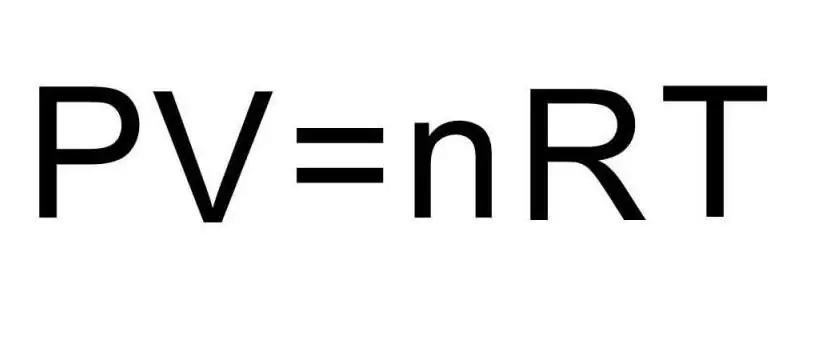
Заттың әртүрлі агрегаттық күйлері мен бір агрегаттық күйдегі процестер арасындағы ауысулар термодинамикамен өңделеді. Қысым, температура және көлем термодинамикалық жүйенің кез келген күйін бірегей түрде анықтайтын үш шама. Идеал газдың күй теңдеуінің формуласы осы үш шаманың барлығын бір теңдікке біріктіреді. Мына формуланы жазайық:
PV=nRT
Мұнда P, V, T - сәйкесінше қысым, көлем, температура. n мәні заттың мольдегі мөлшері, ал R таңбасы газдардың әмбебап тұрақтысын білдіреді. Бұл теңдік қысым мен көлемнің көбейтіндісі неғұрлым көп болса, зат мөлшері мен температураның көбейтіндісі соғұрлым көп болуы керек екенін көрсетеді.

Газдың күй теңдеуінің формуласы Клапейрон-Менделеев заңы деп аталады. 1834 жылы француз ғалымы Эмиль Клапейрон өзінен бұрынғы ғалымдардың тәжірибелік нәтижелерін қорытындылай келе, осы теңдікке келді. Бірақ Клапейрон бірқатар тұрақтыларды қолданды, кейінірек оны Менделеев біреуімен ауыстырды - әмбебап газ тұрақтысы R (8, 314 Дж/(мольК)). Сондықтан қазіргі физикада бұл теңдеу француз және орыс ғалымдарының атымен аталған.

Басқа теңдеу пішіндері
Жоғарыда идеал газдың Менделеев-Клапейрон күй теңдеуін жалпы қабылданған жәнеыңғайлы пішін. Дегенмен, термодинамикадағы есептерде көбінесе сәл басқа форма қажет болуы мүмкін. Төменде жазылған теңдеуден тікелей шығатын тағы үш формула жазылған:
PV=NkBT;
PV=m/MRT;
P=ρRT/M.
Бұл үш теңдеу идеал газ үшін де әмбебап болып табылады, тек оларда тек массасы m, молярлық массасы M, тығыздық ρ және жүйені құрайтын N бөлшектердің саны сияқты шамалар пайда болады. Мұндағы kB таңбасы Больцман тұрақтысын білдіреді (1, 3810-23J/K).
Бойл-Мариотт заңы
Клапейрон өз теңдеуін жасағанда, ол бірнеше ондаған жылдар бұрын эксперименталды түрде ашылған газ заңдарына негізделген. Солардың бірі Бойль-Мариотт заңы. Ол тұйық жүйедегі изотермиялық процесті көрсетеді, соның нәтижесінде қысым мен көлем сияқты макроскопиялық параметрлер өзгереді. Егер идеал газдың күй теңдеуіне T және n тұрақтысын қойсақ, онда газ заңы келесі түрге ие болады:
P1V1=P2V 2
Бұл еркін изотермиялық процесс кезінде қысым мен көлемнің туындысы сақталатынын айтатын Бойль-Мариотт заңы. Бұл жағдайда P және V мәндерінің өзі өзгереді.
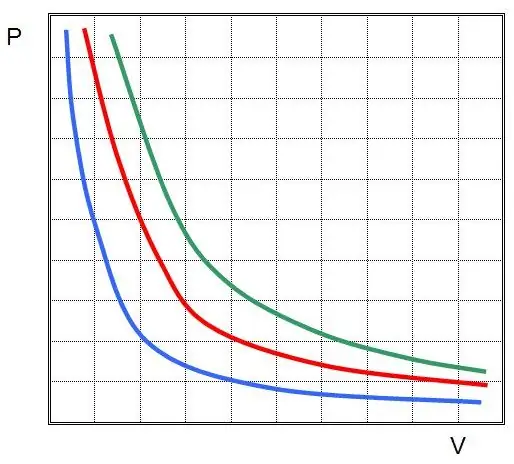
Егер P(V) немесе V(P) графиктерін салсаңыз, изотермалар гиперболалар болады.
Чарльз және Гей-Люссак заңдары
Бұл заңдар математикалық түрде изобарлық және изохоралық сипаттайдыпроцестер, яғни тиісінше қысым мен көлем сақталатын газ жүйесінің күйлері арасындағы осындай ауысулар. Чарльз заңын математикалық түрде былай жазуға болады:
V/T=n кезінде const, P=const.
Гей-Люссак заңы былай жазылған:
P/T=n кезінде тұрақты, V=тұрақты.
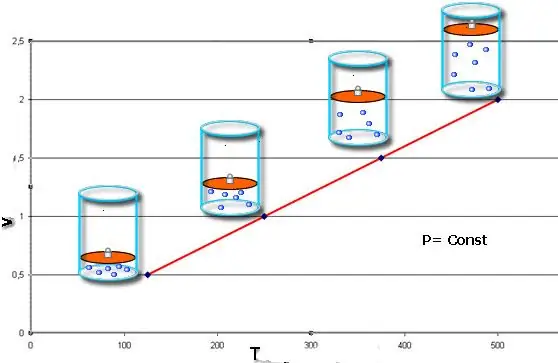
Егер екі теңдік те график түрінде берілсе, онда х осіне қандай да бір бұрыш жасап көлбеу түзулер аламыз. Графиктің бұл түрі тұрақты қысымдағы көлем мен температура арасындағы және тұрақты көлемдегі қысым мен температура арасындағы тура пропорционалдылықты көрсетеді.
Қарастырылған үш газ заңы да газдың химиялық құрамын, сондай-ақ оның зат мөлшерінің өзгеруін ескермейтінін ескеріңіз.
Абсолютті температура
Күнделікті өмірде біз Цельсий температура шкаласын қолдануға дағдыландық, өйткені ол айналамыздағы процестерді сипаттауға ыңғайлы. Сонымен, су 100 oC температурада қайнап, 0 oC температурада қатып қалады. Физикада бұл шкала ыңғайсыз болып шығады, сондықтан 19 ғасырдың ортасында Лорд Кельвин енгізген абсолютті температура шкаласы қолданылады. Осы шкалаға сәйкес температура Кельвинмен (К) өлшенеді.
-273, 15 oC температурада атомдар мен молекулалардың термиялық тербелісі болмайды, олардың алға қозғалысы толығымен тоқтайды деп есептеледі. Цельсий бойынша бұл температура Кельвиндегі абсолютті нөлге (0 К) сәйкес келеді. Осы анықтамаданабсолютті температураның физикалық мағынасы мынадай: бұл затты құрайтын бөлшектердің кинетикалық энергиясының өлшемі, мысалы, атомдар немесе молекулалар.
Абсолюттік температураның жоғарыдағы физикалық мағынасынан басқа, бұл шаманы түсінудің басқа да тәсілдері бар. Солардың бірі Чарльздың аталған газ заңы. Оны келесі пішінде жазайық:
V1/T1=V2/T 2=>
V1/V2=T1/T 2.
Соңғы теңдік жүйедегі заттың белгілі бір мөлшерінде (мысалы, 1 моль) және белгілі бір қысымда (мысалы, 1 Па) газ көлемі абсолютті температураны бірегей түрде анықтайтынын айтады. Басқаша айтқанда, бұл шарттарда газ көлемінің ұлғаюы тек температураның жоғарылауына байланысты мүмкін болады, ал көлемнің төмендеуі Т мәнінің төмендеуін көрсетеді.
Еске салайық, Цельсий температурасынан айырмашылығы абсолютті температура теріс болуы мүмкін емес.
Авогадро принципі және газ қоспалары
Жоғарыда аталған газ заңдарынан басқа, идеал газдың күй теңдеуі де 19 ғасырдың басында Амедео Авогадро ашқан, оның фамилиясымен аталатын принципке әкеледі. Бұл принцип тұрақты қысым мен температурадағы кез келген газдың көлемі жүйедегі зат мөлшерімен анықталатынын бекітеді. Сәйкес формула келесідей:
n/V=P кезінде const, T=const.
Жазбаша өрнек идеалды газ физикасында белгілі газ қоспалары үшін Дальтон заңына әкеледі. Бұлзаң қоспадағы газдың парциалды қысымы оның атомдық үлесімен ерекше анықталатынын айтады.
Есептерді шешу мысалы
Идеал газы бар қатты қабырғалары бар жабық ыдыста қыздыру нәтижесінде қысым 3 есе өсті. Жүйенің соңғы температурасын анықтау қажет, егер оның бастапқы мәні 25 oC.
Алдымен температураны Цельсий градусынан Кельвинге ауыстырайық, бізде:
T=25 + 273, 15=298, 15 K.
Ыдыс қабырғалары қатты болғандықтан, қыздыру процесін изохоралық деп санауға болады. Бұл жағдайда біз Гей-Люссак заңын қолданамыз, бізде:
P1/T1=P2/T 2=>
T2=P2/P1T 1.
Осылайша, соңғы температура қысым қатынасы мен бастапқы температураның көбейтіндісі арқылы анықталады. Деректерді теңдікке ауыстырсақ, жауап аламыз: T2=894,45 К. Бұл температура 621,3 oC сәйкес келеді.






