Термодинамиканың маңызды бөлімі заттың әртүрлі фазалары арасындағы өзгерістерді зерттеу болып табылады, өйткені бұл процестер тәжірибеде орын алады және белгілі бір шарттарда жүйенің әрекетін болжау үшін принципті маңызы бар. Бұл түрлендірулер мақала арналған фазалық ауысулар деп аталады.
Фаза және жүйе құрамдас ұғымы

Физикадағы фазалық ауысуларды қарастыруға кіріспес бұрын, фаза ұғымының өзіне анықтама беру қажет. Жалпы физика курсынан белгілі болғандай, заттың үш күйі бар: газ тәрізді, қатты және сұйық. Ғылымның ерекше бөлімінде - термодинамикада заңдар олардың агрегаттық күйлері үшін емес, материяның фазалары үшін тұжырымдалған. Фаза деп біртекті құрылымы бар, белгілі бір физикалық және химиялық қасиеттерімен сипатталатын және материяның қалған бөлігінен интерфаза деп аталатын шекаралармен бөлінген заттың белгілі бір көлемі түсініледі.
Осылайша, «фаза» ұғымы қасиеттер туралы әлдеқайда маңыздырақ ақпаратты қамтидыматерия оның агрегаттық күйіне қарағанда. Мысалы, темір сияқты металдың қатты күйі келесі фазаларда болуы мүмкін: төмен температурадағы магниттік дене-центрленген текше (BCC), төмен температурадағы магниттік емес бкк, бет-центрленген текше (fcc) және жоғары- температура магниттік емес бcc.
Термодинамика заңдарында «фаза» ұғымымен қатар белгілі бір жүйені құрайтын химиялық элементтердің санын білдіретін «компоненттер» термині де қолданылады. Бұл фазаның монокомпонентті (1 химиялық элемент) немесе көпкомпонентті (бірнеше химиялық элемент) болуы мүмкін екенін білдіреді.
Гиббс теоремасы және жүйенің фазалары арасындағы тепе-теңдік

Фазалық ауысуларды түсіну үшін олардың арасындағы тепе-теңдік шарттарын білу қажет. Бұл шарттарды олардың әрқайсысы үшін Гиббс теңдеулерінің жүйесін шешу арқылы математикалық жолмен алуға болады, бұл ретте тепе-теңдік күйге сыртқы әсерден оқшауланған жүйенің жалпы Гиббс энергиясы өзгеруді тоқтатқанда жетеді.
Көрсетілген теңдеулер жүйесін шешу нәтижесінде бірнеше фазалар арасында тепе-теңдіктің болуы үшін шарттар алынады: оқшауланған жүйе барлық фазалардағы қысымдар, химиялық потенциалдар және температуралар болған кезде ғана өз дамуын тоқтатады. бір-біріне тең.
Тепе-теңдік үшін Гиббс фазалық ережесі

Бірнеше фазалар мен компоненттерден тұратын жүйе тек тепе-теңдікте ғана емесбелгілі бір жағдайларда, мысалы, белгілі бір температура мен қысымда. Тепе-теңдік үшін Гиббс теоремасындағы кейбір айнымалыларды фазалар санын да, осы тепе-теңдікте болатын компоненттер санын да сақтай отырып өзгертуге болады. Жүйедегі тепе-теңдікті бұзбай өзгертуге болатын айнымалылар саны осы жүйенің еркіндік саны деп аталады.
F фазалары мен k құрамдас бөліктерінен тұратын жүйенің l еркіндіктерінің саны Гиббс фазалық ережесінен бірегей түрде анықталады. Бұл ереже математикалық түрде былай жазылған: l + f=k + 2. Бұл ережемен қалай жұмыс істеуге болады? Өте оңай. Мысалы, жүйе f=3 тепе-теңдік фазасынан тұратыны белгілі. Мұндай жүйе құрайтын құрамдастардың ең аз саны қанша болуы мүмкін? Сұраққа келесідей дәлелдеу арқылы жауап беруге болады: тепе-теңдік жағдайында ол белгілі бір көрсеткіштерде ғана жүзеге асырылған кезде ең қатаң шарттар болады, яғни кез келген термодинамикалық параметрдің өзгеруі теңгерімсіздікке әкеледі. Бұл еркіндіктер саны l=0 дегенді білдіреді. l және f белгілі мәндерін ауыстырып, k=1 аламыз, яғни үш фазасы тепе-теңдікте болатын жүйе бір құрамдас бөліктен тұруы мүмкін. Ең жақсы мысал судың үштік нүктесі болып табылады, мұнда мұз, сұйық су және бу белгілі бір температура мен қысымда тепе-теңдікте болады.
Фазалық түрлендірулердің классификациясы
Егер тепе-теңдіктегі жүйедегі кейбір термодинамикалық параметрлерді өзгерте бастасаңыз, бір фазаның қалай жоғалып, екіншісінің пайда болатынын байқауға болады. Бұл процестің қарапайым мысалы - мұздың қыздырылған кезде еруі.
Гиббс теңдеуі тек екі айнымалыға (қысым мен температура) тәуелді екенін және фазалық ауысу осы айнымалылардың өзгеруін қамтитынын ескере отырып, математикалық түрде фазалар арасындағы ауысуды Гиббс энергиясын оның мәніне қатысты дифференциалдау арқылы сипаттауға болады. айнымалылар. Дәл осы тәсілді австриялық физик Пол Эренфест 1933 жылы фазалық тепе-теңдіктің өзгеруімен жүретін барлық белгілі термодинамикалық процестердің классификациясын құрастырған кезде қолданған.
Термодинамика негіздерінен Гиббс энергиясының температураға қатысты бірінші туындысы жүйе энтропиясының өзгеруіне тең екендігі шығады. Қысымға қатысты Гиббс энергиясының туындысы көлемнің өзгеруіне тең. Егер жүйедегі фазалар өзгерсе, энтропия немесе көлем үзілсе, яғни олар кенет өзгерсе, онда олар бірінші ретті фазалық ауысу туралы айтады.
Одан әрі Гиббс энергиясының температура мен қысымға қатысты екінші туындылары сәйкесінше жылу сыйымдылығы және көлемдік кеңею коэффициенті болып табылады. Егер фазалар арасындағы түрлендіру көрсетілген физикалық шамалардың мәндеріндегі үзіліспен бірге жүрсе, онда екінші ретті фазалық ауысу туралы айтылады.
Фазалар арасындағы түрлендіру мысалдары

Табиғатта әртүрлі ауысулардың өте көп саны бар. Осы жіктеу аясында жүйеде көлемдік секіріс болған кезде металдарды балқыту немесе ауадан су буының конденсациялану процестері бірінші түрдегі ауысулардың жарқын мысалдары болып табылады.
Егер екінші ретті ауысулар туралы айтатын болсақ, онда таңқаларлық мысалдар темірдің магниттік күйден температурада парамагниттік күйге айналуы болып табылады.768 ºC немесе абсолютті нөлге жақын температурада металл өткізгіштің асқын өткізгіш күйге айналуы.
Бірінші түрдегі ауысуларды сипаттайтын теңдеулер
Тәжірибеде жүйеде фазалық түрлендірулер болған кезде температураның, қысымның және жұтылатын (босатылған) энергияның қалай өзгеретінін білу жиі қажет. Бұл мақсат үшін екі маңызды теңдеу қолданылады. Олар термодинамика негіздерін білу негізінде алынған:
- Әртүрлі фазалар арасындағы түрлендірулер кезінде қысым мен температура арасындағы байланысты белгілейтін Клапейрон формуласы.
- Трансформация кезінде жұтылған (шығатын) энергия мен жүйе температурасын байланыстыратын Клаузиус формуласы.
Екі теңдеуді де қолдану физикалық шамалардың сандық тәуелділіктерін алуда ғана емес, сонымен қатар фазалық диаграммалардағы тепе-теңдік қисықтарының көлбеуінің белгісін анықтауда.
Екінші түрдегі ауысуларды сипаттайтын теңдеу

1-ші және 2-ші текті фазалық ауысулар әртүрлі теңдеулермен сипатталады, өйткені екінші ретті ауысулар үшін Клаузиус және Клаузиус теңдеулерін қолдану математикалық белгісіздікке әкеледі.
Соңғысын сипаттау үшін трансформация процесі кезінде жылу сыйымдылығы мен көлемдік кеңею коэффициентінің өзгеруін білу арқылы қысым мен температураның өзгеруі арасындағы байланысты орнататын Эренфест теңдеулері қолданылады. Эренфест теңдеулері магнит өрісі болмаған кезде өткізгіш пен асқын өткізгіштің ауысуын сипаттау үшін қолданылады.
Маңыздылықфазалық диаграммалар
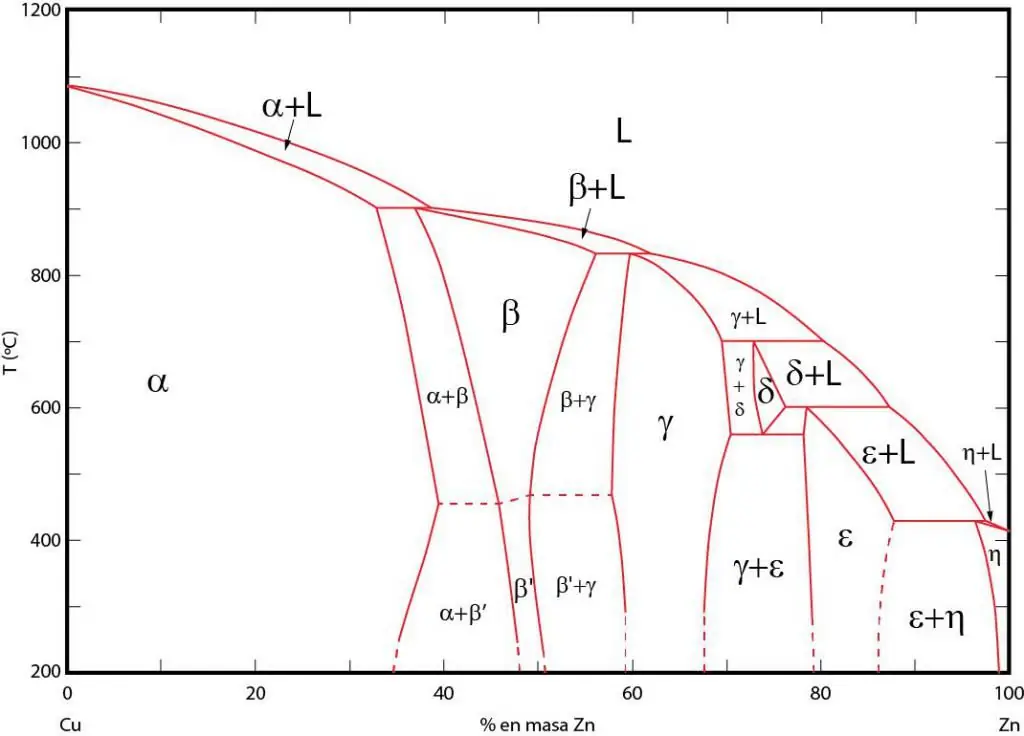
Фазалық диаграммалар - сәйкес фазалар тепе-теңдікте болатын аймақтардың графикалық көрінісі. Бұл аймақтар фазалар арасындағы тепе-теңдік сызықтарымен бөлінген. P-T (қысым-температура), T-V (температура-көлем) және P-V (қысым-көлем) фазалық диаграммалары жиі пайдаланылады.
Фазалық диаграммалардың маңыздылығы мынада: олар сыртқы жағдайлар сәйкес өзгерген кезде жүйенің қандай фазада болатынын болжауға мүмкіндік береді. Бұл ақпарат қажетті қасиеттері бар құрылымды алу үшін әртүрлі материалдарды термиялық өңдеуде қолданылады.






